Pfizer
- Covid-19

Estado recebe 3 milhões de doses bivalentes da Pfizer
Vacina é atualizada e oferece maior proteção contra variantes
- Covid-19

Brasil recebe novo lote de vacina para crianças
É o quarto lote de vacinas pediátricas entregue ao Brasil
- Covid-19

União Europeia libera pílula anticovid-19
Medicamento Paxlovid da Pfizer é autorizado para tratamento de adultos
- Covid-19

Novo lote de vacina para crianças chega ao Brasil
Saúde negocia a compra de doses do Butantan
- Covid-19

Novas doses de vacina para crianças chegam ao Brasil
Entrega estava prevista para o dia 20 e foi antecipada
- Covid-19

Primeiras vacinas para crianças chegam ao Brasil
São Paulo ficará com 20,73% das doses para crianças
- Covid-19

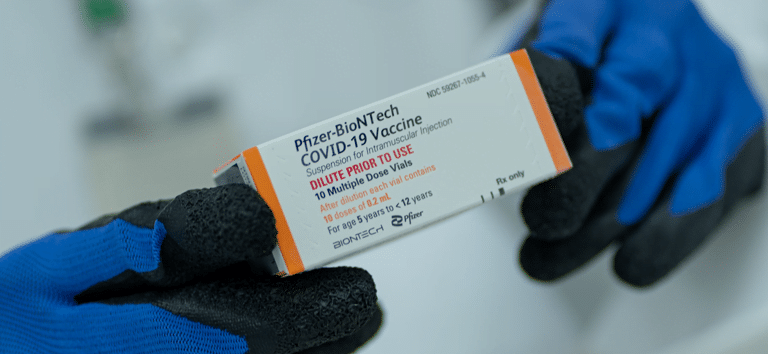
Anvisa faz recomendações para uso de vacina da Pfizer em crianças
Vacina da Pfizer para crianças terá dose menor e frasco na cor laranja
- Mundo

Agência da UE aprova vacina para crianças a partir de 5 anos
Vacina da Pfizer será usada para proteger crianças, com 90,7% de eficácia
- Covid-19

Pfizer diz que pílula reduz em 89% risco de morte por covid-19
Nenhum dos participantes do estudo havia sido vacinado contra a covid-19
- Mundo

EUA aprovam vacina da Pfizer para crianças de 5 a 11 anos
28 milhões de crianças no país poderão receber vacina da Pfizer